OSTALI SEMINARSKI RADOVI
IZ HEMIJE: |
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
Karboksilne kiseline i derivati karboksilnih kiselina
Osnovne osobine kiselina
Kiseline su supstance koje disociraju u vodi i daju hidrogenove jone (H+). Kiseline su kiselog okusa, imaju pH vrijednost nižu od 7, i farbaju plavi lakmus papir u crveno. Kada kiselina disocira u vodi radi davanja hidro-genovih jona, hidrogenovi joni ne ostaju kao individualni joni, već ih
privlači polarnost molekula vode kao što vidi-mo u sljedećoj reakciji:
H+ + H2O![]() H3O+ . Radi tehničke tačnosti, gorenavedena Arrhe-niusova definicija
bi trebala glasiti: kiselina su supstance koje proizvode hidrogenove
jone u rastvoru. Bitno za zapamtiti je to da hidroge-novi joni ne stoje
kao zasebni joni u vodi, već postaju hidratizirani. H+ bi trebali biti
interpre-tirani kao hidronijumovi joni, a ne hidrogenovi joni. Kroz
ovaj seminarski rad biti će tretirani kao sinonimi. Tabela 1 pokazuje
prisustvo hidrogena u kiselinama. Postoje tri definicije kiselina, koje
su prikazane u tabeli 2. Bitno je da znamo da ime kiselina nije „naljepnica“
koju možemo dati nekoj supstanci, što su dokazali Bronsted-Lowry i Lewis.
Kiselinske
H3O+ . Radi tehničke tačnosti, gorenavedena Arrhe-niusova definicija
bi trebala glasiti: kiselina su supstance koje proizvode hidrogenove
jone u rastvoru. Bitno za zapamtiti je to da hidroge-novi joni ne stoje
kao zasebni joni u vodi, već postaju hidratizirani. H+ bi trebali biti
interpre-tirani kao hidronijumovi joni, a ne hidrogenovi joni. Kroz
ovaj seminarski rad biti će tretirani kao sinonimi. Tabela 1 pokazuje
prisustvo hidrogena u kiselinama. Postoje tri definicije kiselina, koje
su prikazane u tabeli 2. Bitno je da znamo da ime kiselina nije „naljepnica“
koju možemo dati nekoj supstanci, što su dokazali Bronsted-Lowry i Lewis.
Kiselinske

karakteristike zavise od reakcije koja se dešava između supstanci. Supstanca može da se ponaša kao kiselina u zavi-snosti od uvjeta. Takve supstance se nazivaju amfoterne.

Osnovne osobine karboksilnih kiselina
Karboksilne kiseline sadrže karboksilnu grupu (COOH), koja ima jedan atom kisika koji je vezan dvostrukom vezom za atom karbona i hidroksilnu grupu (OH) koja je jednostrukom vezom vezana za atom karbona. Karboksilna grupa takodjer mora biti vezana za hidrogen ili za neku organsku grupu. Karboksilne kiseline su Bronstedske kiseline, odnosno donori protona. Soli i anioni

karboksilnih kiselina se nazivaju karboksilati. Karboksilna kiselina ravnog lanca naziva se alifatička kiselina. Prema IUPAC-ovom sistemu nomenklature atom karbona u karboksilnoj grupi se označava kao broj 1.
Hemijska svojstva karboksilnih kiselina
Karboksilne kiseline su najjače kiseline u organskoj hemiji. Karboksilatni jon koji se formira poslije donacije protona se stabilizuje energijom rezo-nancije. Grupa odlazećih elektrona atoma karbona dodatno stabilizuje konjugovanu bazu i povećava kiselost karboksilne kiseline.

Tačke ključanja karboksilnih kiselina rastu s veličinom na normalan način, ali tačke topljenja ne rastu. Naime, jednolančane karboksilne kise-line sastavljene od parnog broja atoma karbona imaju više tačke topljenja nego neparni lanci koji imaju jedan atom karbona više ili manje.
Ovo pokazuje razlike u međumolekularnim privlačnim silama u kristalnom stanju. Prisustvo cis dvostruke veze dodatno snižava tačku topljenja jedinjenja. Zasićene karboksilne kiseline sa više od 8 atoma karbona su uglavnom u čvrstom stanju. Dvostruka veza kod nezasićenih karboksilnih kiselina lomi rešetke i snižava temperaturu topljenja. Karboksilne kiseline su rastvorljive u vodi. Rastvorljivost opada sa rastom molekularne mase ili raste sa brojem atoma karbona. Karboksilne kiseline sa deset i više molekula karbona su nerastvorljive u vodi. Rastvorljivost se javlja zbog vodikovih veza.
Dekarboksilacija
Gubitak karbon dioksida iz karboksilnih kiselina naziva se dekarboksi-lacija. Reakcija je egzotermička. Jednostavne karboksilne kiseline rijetko ulaze u proces dekarbo-
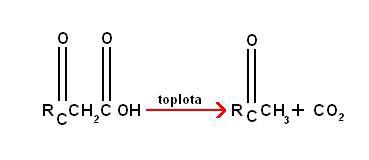
ksilacije, pošto je potrebna velika energija aktivacije. Ipak, karboksilne kiseline sa karbonilnom grupom na 3- (ili b-) poziciji redovno podilaze termalnoj dekarboksilaciji.
Postoje dva razloga zašto beta keto kiseline ulaze u dekarboksilne reakcije.
1. Dekarboksilacija karboksilnog aniona stvara rezonancijom stabilizovanog
aniona enola.
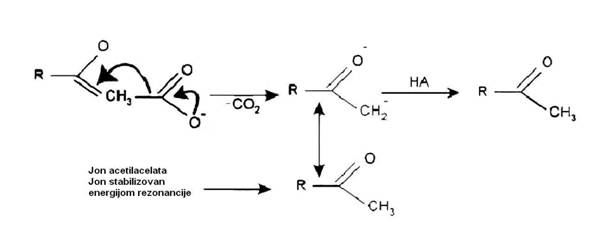
Ovaj anion je mnogo stabilniji od aniona RCH3:- To se pravi dekarbo-ksilacijom običnog aniona karboksilne kiseline.
2. Kada se kiselina dekarboksiluje, prolazi kroz šestodijelno ciklično
tranziciono stanje.
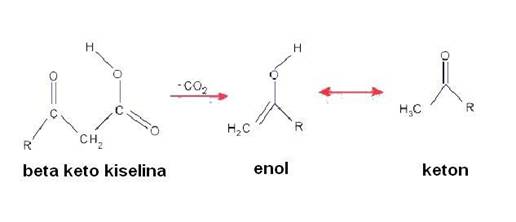
Reakcija direktno stvara enol, koji je tautomer metil-ketonu.
Derivati karboksilnih kiselina
Derivati karboksilne grupe su supstance u kojima je hidroksilna grupa
zamijenjena halogenom, drugom karboksilnom grupom, alkoksilnom grupom
itd. Derivati karboksilnih kiselina su prikazani na tabeli 4 na strani
6. Derivati karboksilne kiseline hidrolizom daju karboksilnu kiselinu.
(tabela 5 na strani 8)
Tabela : Derivati karboksilnih kiselina
Acil halogenidi

Kod karboksilnih kiselina, acil halo-genidi sadrže –COX funkcionalnu
grupu koja se sastoji od karbonilne grupe jednostrukom vezom vezane
za atom halogena. Generalna formula za takve acil halogenide glasi RCOX,
gdje R može biti npr. alkilna grupa, CO je karbonilna grupa a X predstavlja
halogen. Osnov i naziva odgovarajuće kiseline dodajemo sufiks –oil,
a zatim se navodi taj atom halogena. Acil halogenidi su reaktivne supstance
koje se često koriste kao posrednici pri sintezi drugih organskih jedinjenja.
Npr. acil halogenidi mogu reagovati s vodom da daju karboksilnu kiselinu.
Ova hidroliza je način na koji se najviše iskorištavaju acil halogenidi,
pošto se tako vrši industrijska sinteza acetatne kiseline.

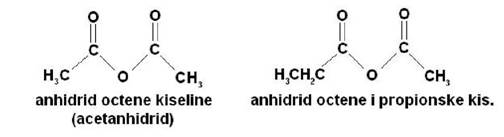
Anhidridi karboksilnih kiselina
Anhidridi karboksilnih kiselina su organska jedinjenja koja imaju dvije
acilne grupe vezane za isti atom kisika. Pri imenovanju jedinjenja,
riječ anhidrid se dodaje na naziv odgovarajuče kiseline. U slučaju da
su skupine koje se vežu za zajednički kisik jednake, navodi se naziv
kiseline bez prefiksa di-. Ako su za atom kisika vezane dvije različite
skupine, nazivi karboksilnih kiselina pišu se kao dvije odvojene riječi.
Esteri karboksilnih kiselina
Esteri su u hemiji organske tvari u kojima organska grupa zamjenjuje jedan ili više atoma hidrogena u hidroksilnoj grupi. Esteri nastali hemijskom reakcijom s karboksilnim kiselinama imaju opću formulu
RCOOR’.
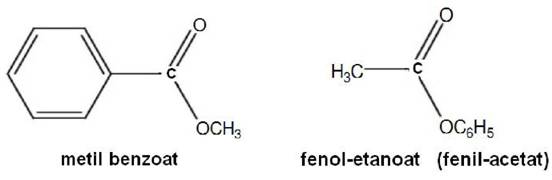
Naziv supstancama dodjeljujemo povezivanjem alkoholnog i kiselinskog dijela molekule (korijen alkoholnog nastavka dobija nastavak –il, kao da je supstituent, ali se piše na početko i kao odvojena riječ, a zatim slijedi osnovni naziv kiseline sa nastavkom –oat). Naziv esterske skupine kao supstituenta tvori se pomoću izraza alkoksikarbonil.
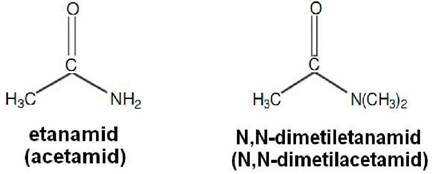
Amidi
Amid je organsko jedinjenje koje sadrži funkcionalnu grupu koja se sastoji od acil grupe (R-C=O) vezane za atom nitrogena. Termin se odnosi na klasu jedinjenja, kao i na funkcionalnu grupu unutar tih jedinjenja. Najjednostavniji amidi su derivati amonijaka u kojima je atom hidrogena zamenjen acil grupom (RC(O)NH2). Blisko srodni, i znatno brojniji, su amidi izvedeni iz primarnih amina (R'NH2) sa formulom
RC(O)NHR'. Amidi su takođe često izvedeni iz sekundarnih amina
(R'RNH) te je njihova formula RC(O)NR'R. Amidi se obično smatraju
derivatima karboksilnih kiselina u kojima je hidroksilna grupa zamijenjena
aminom ili amonijakom. Imenujemo ih tako da na osnovu imena kiseline
dodamo nastavak –amid.
Nitrili
Nitrili su sve organske supstance koje imaju -C≡N
funkcionalnu grupu. Većinom su netopljivi u vodi, a topljivi u alkoholu
i eteru. Nastaju djelovanjem alkalijskih cijanida na organske halogenide.
Djelovanjem kiselina ili alkala prelaze u karboksilne kiseline s istim
brojem ugljikovih atoma (skupina CN prelazi u COOH), pa mogu biti međuproizvodi
u sintetskom postupku kojim se povećava broj ugljikovih atoma u lancu
organskog spoja. Imenujemo ih tako što na ime osnovne kiseline dodajemo
sufiks –nitril, a numeriranje uključuje ugljik nitrila. Ako je CN skupina
supstituent dodaje se prefiks cijano-.

Tabela : Hidroliza derivata karboksilne kiseline
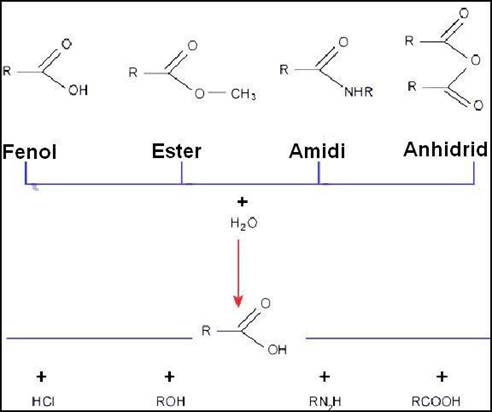
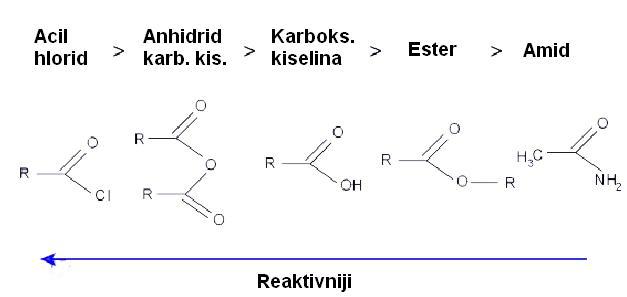
Tabela : Odnos reaktivnosti supstanci
![]()
- Osnove organske kemije -nastavni tekst-dr.sc. Igor Jerković
LITERATURA
- Carboxylic Acid-djelo neimenovanog učenika neke ustanove u SAD
- Organska kemija, natuknice uz predavanja-prof.dr.sc. Vladimir Rapić
- The basics of chemistry-Richard Myers
- Wikipedia-slobodna enciklopedija
preuzmi
seminarski rad u wordu » » »


