OSTALI SEMINARSKI RADOVI
IZ HEMIJE: |
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
Površinski napon
Tečnost, ili tečna tela prestavljaju jedno od četiri agregatna stanja
. Ona se bitno razlikuje od, po osobinama, čvrstih tela sa jedne,
i gasova sa druge strane. Ovo pravilo važi zbog medjumolekulskih sila
koje su jače nego kod bilo kog čvrstog tela i slabije od bilo kog gasa,
u odnosu na isti kod tečnosti.
Is toga proizilaze i neke osnovne osobine tečnosti, kao što su, nepostojnost
stalnog oblika, translatorno kretanje molekula tečnosti od sudara do sudara,
njena nestišljivost i nepostojanje unutrašnjeg trenja.
Takodje važno je napomenuti da te osobine stvaraju različite posledice,
primer posledica koje nastaju dejstvom medjumolekulskih sila, je sigurno
pojava površinskog napona.
1. FLUIDI
Fluid prestavalja stanje materije u kome ona može da teče i menja oblik
i zapreminu pod dejstvom veoma slabih sila. Takodje on prestavlja i neprekidnu
sredinu, kontinijum. Hipotezu o neprekidnosti fluidne sredine postavio
je Dalamber 1744. godine.
I fluid se u Hidraulici posmatra kao neprekidna sredina koja ispunjava
prostor bez ikakvih šupljina, tj. kao kontinuum. Zanemaruje se molekularni
sastav materije i smatra da se tečnosti i gasovi sastoje iz delića koji
sadrže vrlo veliki broj molekula.
Pod delićem se podrazumeva elementarna količina tečnosti ili gasa čiji
oblik ne igra ulogu ni pri mirovanju ni pri kretanju. Zato delić može
da se zamisli kao sasvim mala kocka, lopta, valjak, tetraedar ili bilo
koje drugo geometrijsko telo. Delić je potpuno ispunjen materijom i ima
uvek istu masu. Masa dm delića fluida ne menja se za vreme kretanja ili
mirovanja ali se oblik i zapremina delića mogu menjati u toku vremena.
U prostoru koji fluid zauzima raspored delića fluida je takav da se ne
javljaju praznine. Dimenzije delića ne smeju se poistovetiti sa molekulom.
Pretpostavka o neprekidnom ispunjavanju prostora omogućava primenu diferencijalnog
i integralnog računa u Hidraulici, čime su matematički obuhvaćeni i rešeni
mnogi problemi. Delići tečnosti su veoma pokretljivi. Pokretljivost delića
gasova je još veća. Zbog ove pokretljivosti na tečnost ne mogu da deluju
koncentrisane sile već samo sile neprekidno raspoređene po čitavoj masi
ili površini tečnosti.
1.1 Sile koje deluju na fluid
Posmatra se zapremina V fluida ispunjena masom m. Ako fluid miruje, na ovu masu deluje Zemljina teža i pritisne sile okolnog fluida. Ako se fluid kreće, deluju još i sile inercije i sile trenja. Sila Zemljine teže (zapreminska sila) deluje na svaki delić fluida u posmatranoj zapremini, a time i na ukupnu masu m. Zapreminske sile su posledica polja sila u kome se fluid nalazi, pa se nazivaju još spoljašnjim ili silama polja. Zapreminske sile se računaju u odnosu na jedinicu mase fluida. Ako je sila f koja deluje na jedinicu mase, onda na elementarnu masu dm delića fluida deluje zapreminska sila.
f dm, f{X,Y, Z}
Zapremina V fluida podeliće se na delove 1 i 2. Uticaj dela 2 na deo 1 može da se zameni malom silom ΔR koja deluje na proizvoljno izabranu površinicu ΔA Na svaki drugi deo ΔA površi A delovaće neka sila ΔR pri čemu ove sile nisu međusobno jednake.
Površinska sila može se razložiti na komponentu ΔN normalnu na površinicu i na komponentu ΔT koja leži u ravni površinice.
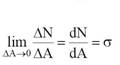
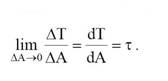
normalni tangentni
Kod fluida od normalnih napona može da postoji samo pritisak p (napon na istezanje bi vrlo lako razdvojio deliće fluida).
Pritisak se u proizvoljnoj tački M fluida definiše kao
![]()
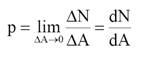
- Intenzitet elementarne sile pritiska dp iznosi:
dP = p dA
- Elementarna sila pritiska:
dP = − p dA.
- Natpritisak ili manometarski pritisak:
pm = p − pa
- Potpritisak ili vakuumski pritisak:
pv = pa- p
2. POVRŠINSKI NAPON
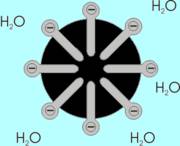
Molekul u unutrašnjosti tečnosti (vidi sliku) okružen je sa svih strana
istim takvim molekulima tako da je rezultujuća sila međumolekulskog privlačenja
nula. Molekul na površini tečnosti okružen je s jedne strane istim takvim molekulima
tečnosti, a s druge strane molekulima gasa (vazduha). Pošto se u jedinici
zapremine gasne faze nalazi znatno manji broj molekula nego u istoj zapremini
tečne faze, međumolekulska privlačenja neće biti uravnotežena, već će
postojati rezultujuća sila usmerena ka unutrašnjosti tečnosti. Ovo nesimetrično
polje sila oko molekula na površini dovodi do pojave površinskog napona,
σ, koji predstavlja silu koja deluje tangencijalno na površinu tečnosti,
[N/m].
Molekul na površini tečnosti okružen je s jedne strane istim takvim molekulima
tečnosti, a s druge strane molekulima gasa (vazduha). Pošto se u jedinici
zapremine gasne faze nalazi znatno manji broj molekula nego u istoj zapremini
tečne faze, međumolekulska privlačenja neće biti uravnotežena, već će
postojati rezultujuća sila usmerena ka unutrašnjosti tečnosti. Ovo nesimetrično
polje sila oko molekula na površini dovodi do pojave površinskog napona,
σ, koji predstavlja silu koja deluje tangencijalno na površinu tečnosti,
[N/m].
Površinski napon se javlja kao posledica postojanja kohezionog (unutrašnjeg) pritiska, tj. sile koja povlači molekule ka unutrašnjosti tečnosti i čiji je pravac normalan na površinu tečnosti. Zahvaljujući tome tečnost teži da smanji površinu na minimalnu pri datim uslovima. Zato tečnost u odsustvu spoljnih sila teži da zauzme oblik lopte (kapi tečnosti), jer je površina lopte najmanja površina za datu zapreminu, pa će površinska energija sistema pri tome biti minimalna. Da bi se povećala površina tečnosti neophodno je da se utroši rad da se molekuli iz unutrašnjosti tečnosti dovedu na površinu. Rad se troši na savladavanje međumolekulskih sila pri prelaženju molekula iz unutrašnjosti tečnosti na površinu. Rad izvršen za stvaranje jedinice površine, pri povratnom izotermskom procesu, pre-dstavlja površinsku slobodnu energiju. Površinska slobodna energija u J/m2 brojno je jednaka površinskom naponu u N/m u slučaju jednokomponentnih tečnosti.
Površinski napon tečnosti zavisi od intenziteta međumolekulskih sila privlačenja unutar tečnosti. Tako je površinski napon tečnosti, čiji molekuli ne poseduju dipole relativno mali i iznosi
oko 30×10−3 N/m. Voda čiji molekuli predstavljaju izrazite dipole ima relativno veliki površinski napon koji na 20°C iznosi 72,75×10−3 N/m (tabela 1).
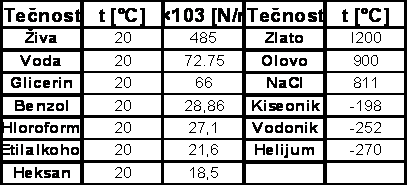
(tabela 1)
Sa porastom temperature površinski napon tečnosti opada (tabela 2) sve do temperature bliske kritičnoj. Na kritičnoj temperaturi nestaju razlike između gasne i tečne faze i površinski napon postaje jednak nuli.
Smanjenje površinskog napona sa porastom temperature se odigrava zato što na višim temperaturama dolazi do povećanja intenziteta toplotnog kretanja molekula, što deluje na smanjenje sila privlačenja između njih, pa prema tome i do sniženja površinskog napona.

(tabela 2)
2.1 Površinski napon na granici tečnosti-tečnost
Za tečnosti koje se ne mešaju i koje se ograničeno rastvaraju jedna u drugoj važi pravilo Antonova- površinski napon na graničnoj površini izmedju tečnosti A i B je približno jednak razlici površinskih napona, uzajamno zasićenih tečnosti jedne s drugom (AZ, BZ), na granici s vazduhom:
![]() (tabela 1)
(tabela 1)
- nemešljive tečnosti : voda-benzol (C6H6), voda-ugljentetrahlorid (CCl4), voda bromoform (CHBr3), voda-hloroform (CHCl3),
- Prisustvo jedne tečnosti iznad sloja druge dovodi do sniženja površinskog napona, pošto se smanjuje nekompenzovanost sila na graničnoj površini dveju tečnosti koje su u kontaktu,
- što je veće privlačenje između molekula dva različita sloja tečnosti na graničnoj površini to će međupovršinski napon biti manji (sniženje površinskog napona na graničnoj površini tečnost-tečnost je utoliko veće što je manja razlika u polarnosti dveju tečnosti koje se ne mešaju; tečnosti bliske po polarnosti mešaju se jedna s drugom u svim odnosima i zato je međupovršinski napon za njih jednak nuli).
U tabeli (3) dati su površinski naponi na graničnoj površini dva sloja tečnosti koje su uzajamno zasićene jedna s drugom, pri čemu je jedna od tečnosti voda a druga organska tečnost i površinski naponi tečnosti zasićenih jedna s drugom na granici s vazduhom. Vidi se da postoji odli-čno slaganje između izračunatih vrednosti površinskog napona na granici organska tečnost-voda po pravilu Antonova I eksperimentalno određenih vrednosti.
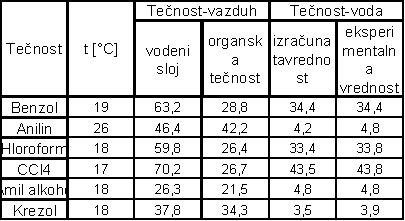
(tabela 3)
Međupovršinski napon opada sa porastom temperature i približava se nuli kada se temperatura približava kritičnoj temperaturi rastvorljivosti. Na nekoj temperaturi na kojoj dolazi do potpunog mešanja dve posmatrane tečnosti nestaju dve faze pa se može reći da je u takvim uslovima međupovršinski napon jednak nuli.
Površinski napon čvrstih tela, kako na granici sa gasnom tako i sa tečnom fazom ne može se direktno meriti. Za njegovo određivanje koriste se indirektne metode.
2.2 Površinski napon rastvora
- Materije koje nemaju uticaja na površinski napon rastvarača
- Takve materije imaju površinski napon blizak površinskom naponu rastvarača(u odnosu na vodu takva materija je npr. saharin).
- Površinski neaktivne materije
- imaju površinski napon veći od površinskog napona rastvarača,
- relativno veliku rastvorljivost,
- u odnosu na vodu površinski neaktivne materije su elektroliti ( kiseline, baze i soli).
- Površinski aktivne materije (PAM)
- adsorbuju se na graničnoj površini tečnost-gas

Adsorpcija PAM na graničnoj površini voda-vazduh
- slabo rastvorljive u vodi
- mali površinski napon
- Površinski aktivne materije već pri malim koncentracijama dovode do znatnog sniženja površinskog napona vode Tako, već pri koncentraci-jama površinski aktivnih materija od 0,4% i manjim, površinski napon vode se snižava od 72,75×10−3 N/m do 40×10−3 - 20×10−3 N/m na 20°C. Npr. 0,1% vodeni rastvor Na-oleata ima površinski napon 27,2×10−3 N/m na 20°C
- U odnosu na vodu površinski aktivnim materijama smatraju se mnoge organske materije i to: masne kiseline, soli masnih kiselina (sapuni), sulfo kiseline i njihove soli (sulfonati), alkoholi, amini itd. Za molekule ovih supstanci karakteristična su dva dela: polarna grupa (–COOH, –COONa, –SO3H, –SO3Na, –OH, –NH2 itd.) i apolarni ugljovodonični radikal. Polarna grupa je hidrofilni deo molekula pošto raspolaže znatnim dipolnim momentom i lako hidratiše, pa uslovljava afinitet površnski aktivne materije prema vodi
- Površinski aktivne materije (PAM) prema tipu polarne (hidrofilne) grupe mogu biti:
- anjonske, raspolažu na kraju ugljovodoničnog lanca nekom od anjonskih grupa kao šo su: –COOH, –COONa, –O–SO3H, –O–SO3Na, –SO3Na itd. Anjonski PAM su npr.: K-laurat (CH3–(CH2)10 –COO− K+), Na-dodecilsulfat (CH3–(CH2)11 – SO4− Na+), Na-dodecilsulfonat (CH3– (CH2)11–SO3− Na+).
- katjonske, su heksadecil-trimetilamonijum bromid (CH3–(CH2)15− N+(CH3)3 Br−), dodecilamin hidrohlorid (CH3– (CH2)11 –N+ H3Cl−) i dr.
- nejonske, najčešće imaju u svom sastavu hidroksilnu (–OH) grupu ili polioksietilenski lanac [–(CH2–CH2–O)n)–] koji predstavljaju hidrofilni, polarni deo molekula. Supstance koje se u svojstvu PAM koriste za regulisanje površinskog napona na granici vodeni rastvor-vazduh i stvaranje pene (tzv. pe-nušači) u procesima flotacijske koncentracije različitih ruda pripadaju baš grupi nejonskih PAM
- amfolitičke, se mogu, zavisno od pH da se u vodenom rastvoru ponaša kao anjonska, katjonska ili nejonska PAM
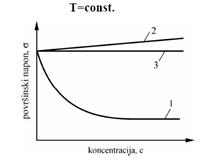 Molekuli površinski aktivne supstance se orijentišu pri adsorbovanju na površini tako da im se hidrofobni deo, tj. ugljovodonični lanac orijentiše prema vazduhu, a polarna hidrofilna grupa prema vodi, što se da videti na donjoj slici.
Molekuli površinski aktivne supstance se orijentišu pri adsorbovanju na površini tako da im se hidrofobni deo, tj. ugljovodonični lanac orijentiše prema vazduhu, a polarna hidrofilna grupa prema vodi, što se da videti na donjoj slici.
- Metode određivanja površinskog napona tečnosti
 metoda stalagmometra, određivanje površinskog
napona preko određivanja mase kapi
metoda stalagmometra, određivanje površinskog
napona preko određivanja mase kapi
Masa kapi tečnosti koja ističe iz kapilare je proporcionalna površinskom naponu tečnosti. Da bi se kap, koja se formira na kraju kapilare, otkinula potrebno je da se savlada površinski napon. Ukoliko je površinski napon veći potrebna je veća masa kapi da bi se savladao površinski napon i utoliko će manji broj kapi da se formira iz iste zapremine tečnosti. Dakle, masa kapi upravo je proporcionalna, a broj kapi iz određene zapremine tečnosti obrnuto proporcionalan površinskom naponu. Metodom stalagmometra površinski napon se određuje poređenjem broja kapi koji isteče iz zapremine V (zapremina proširenja A) ispitivane tečnosti sa brojem kapi iste zapremine tečnosti-etalona (najčešće destilovana voda), čiji je površinski napon poznat.
Pošto je V⋅d jednako masi ukupne zapremine tečnosti, gde je d gustina tečnosti, to će masa jedne kapi da bude jednaka V⋅d/n, gde je n broj kapi iz zapremine V. Kako je masa kapi srazmerna površinskom naponu sledi :
![]()
Isti izraz se može napisati i za destilovanu vodu, koja u ovom slučaju služi kao etalon:
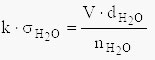
pri čemu je k - konstanta koja zavisi od dimenzija i konstrukcije stalagmometra.
Deljenjem prve jednačine sa drugom jednačinom dobija se konačan izraz za određivanje površinskog napona tečnosti:
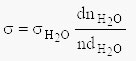
- Metoda određivanja površinskog napona torzionom vagom ili tenziometrom po Di Noju (Du Noüy), zasniva na određivanju sile potrebne da se platinski prsten odvoji od površine tečnosti nasuprot delovanju površinskog napona

Torziona vaga
Površinski napon se izračunava iz izraza:
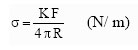
Gde je F - sila u N, R - poluprečnik platinskog prstena u m, a K - konstanta koja zavisi od dimenzija platinskog prstena, kao i od gustine i površinskog napona tečnosti
2.3 Kohezija
Kohezija (lat. cohaerere "držati se
skupa") ili kohezivna privlačnost ili kohezivna sila je fizikalna
osobina supstance, uzrokovana međumolekularnim privlačenjem između
sličnih molekula unutar tela ili supstance koja ih nastoji ujediniti.
Voda, na primer, je jako kohezivna zbog velike polarnosti koju prave
hidrogenske veze u tetraedarskoj konfiguraciji. Rezultat je relativno
jaka Coulombova sila (čitaj: Kulonova sila) između molekula. Van der
Waalsovi plinovi kao što su metan, međutim, imaju slabu koheziju samo
zbog Van der Waalsove sile koji postoje zbog nastalog polariteta u
nepolarnim molekulama.
Kohezija, zajedno sa adhezijom (privlačenje između različitih molekula),
pomaže u objašnjavanju fenomena kao što su površinski napon i kapilarnost.
2.4 Dodirni uglovi
Pošto nijedna tečnost ne može dugo opstati u savršenom vakuumu, površina bilo koje tečnosti i granica između te tečnosti i nekog drugog medija. gornja površina bare, na primer, je granica između vode iz bare i vazduha. Površinski napon, tada, nije osobina samo tečnosti, nego i osobina granice te tečnosti sa drugim medijem. Ako je tečnost u spremniku, tada, osim granice tečnost-gas na gornjoj površini, postoji, također, granica između tečnosti i zidova spremnika. Površinski napon između tečnosti i vazduha obično je različit (veći) od površinskog napona sa zidovima spremnika. A gde se dve površine sreću, njihova geometrija mora biti takva da se sve sile uravnoteže.Sila u tačkama dodira prikazana za ugao dodira veći od 90° (levo) i manju od 90° (desno)
Gdje se dve površine sreću, one formiraju dodirni ugao![]() , koji je ugao kojeg tangenta na površinu pravi sa čvrstom površinom. Dijagram na desnoj strani prikazuje dva primera. Naponske sile su prikazane na granicama tečnost-vazduh, tečnost-čvrsto telo i čvrsto telo-vazduh. Primer levo prikazuje slučaj kada je razlika između površinskog napona tečnost-čvrsto telo i čvrsto telo-vazduh,
, koji je ugao kojeg tangenta na površinu pravi sa čvrstom površinom. Dijagram na desnoj strani prikazuje dva primera. Naponske sile su prikazane na granicama tečnost-vazduh, tečnost-čvrsto telo i čvrsto telo-vazduh. Primer levo prikazuje slučaj kada je razlika između površinskog napona tečnost-čvrsto telo i čvrsto telo-vazduh, ![]() , manja od površinskog napona tečnost-vazduh,
, manja od površinskog napona tečnost-vazduh, ![]() , ali je i pored toga pozitivna, to jest
, ali je i pored toga pozitivna, to jest
![]()
Na dijagramu, i vertikalne i horizontalne sile moraju se poništitiu istoj tački. Horizontalna komponenta od ![]() se poništi sa adhezivnom silom,
se poništi sa adhezivnom silom, ![]() :
:
![]()
Vertikalna komponenta od ![]() mora poništiti silu,
mora poništiti silu, ![]() :
:
![]()
Pošto su sile direktno proporcionalne njehovim površinskim naponima
(respektivno), imamo da je:
![]()
Ovo znači da je, uprkos poteškoćama u direktnom merenju razlike
između površinskih napona tečnost-čvrsto telo i čvrsto telo-vazduh,
![]() ,
moguće zaključiti koliko oni iznose pomoću merenja dodirnog ugla (koji
se lako izmeri),
,
moguće zaključiti koliko oni iznose pomoću merenja dodirnog ugla (koji
se lako izmeri), ![]() ,
ako je površinski napon tečnost-vazduh,
,
ako je površinski napon tečnost-vazduh, ![]() ,
poznat.
,
poznat.
Isti odnos postoji i kod dijagrama na slici. Ali u ovom slučaju vidimo
da je, zbog činjenice da je dodirni ugao manji od 90°, razlika površinskog
napona tečnost-čvrsto telo/čvrsto telo-vazduh mora biti negativna:
![]()
2.4.1 Posebni dodirni uglovi
Uočite da je, u posebnom slučaju granice voda-srebro, gde je dodirni ugao jednak 90°, razlika površinskog napona tečnost-čvrsto telo/čvrsto telo-vazduh razlika jednaka nula.
Drugi posebni slučaj je kada je dodirni ugao 180°. Voda sa posebno pripremljenim teflonom približno ima tu vrednost dodirnog ugla. Dodirni ugao od 180° pojavljuje se kada je površinski napon tečnost-čvrsto telo tačno jednak površinskom naponu tečnost-vazduh.
![]()
3. SURFAKTANTI
Surfaktanti ili tenzidi su supstance koje snižavaju površinski napon vode u odnosu na vazduh ili u odnosu na graničnu površinu sa drugim supstancama. Reč surfaktant potiče od engleskog naziva za površinski aktivne supstance - surface acting agent. Surfaktanti se primjenjuju kao sredstva za čišćenje, a također i u tekstilnoj industriji kao sredstva za kvašenje, emulgaciju i omekšavanje.
3.1 Struktura i delovanje surfaktanata
Površinski aktivne supstance se u rastvoru raspoređuju tako da je
njihova koncentracija na graničnoj površini veća od koncentracije
u unutrašnjosti rastvora. To omogućava njihova struktura koja se sastoji
od hidrofobnog i hidrofilnog dela molekule.
Hidrofobni deo je alifatski ugljikovodični lanac (ravan ili razgranat).
Hidrofilni deo molekule ima afinitet prema vodi, a to može biti hidrofilna
grupa npr. karboksilna, sulfatna, sulfonska, ortofosforna, amino grupa,
sulfonamidna, itd. Pri povećanoj koncentraciji surfaktanta dolazi
do formiranja submikroskopskih čestica (micele) u unutrašnjosti rastvora.
Micele su građene od nekoliko stotina molkula čiji su hidrofilni delovi
okrenuti prema vodi, a hidrofobni lanci prema unutrašnjosti. Ova pojava
omogućava solubiizaciju dve tečnosti koje se ne mešaju, tj. prividno
povećanje rastvorljivosti. Npr. emulzija vode i ulja biće stabilna
u prisustvu površinski aktivne supstance.
4. WEBEROV BROJ
Weberov broj je bezdimenzionalni broj u mehanici fluida koji je često koristan u analizi strujanja fluida gde postoji granica između dva različita fluida, posebno za višefazna strujanja kod jako zakrivljenih površina. Ovaj broj može se predstaviti kao mera relativne važnosti inercije fluida u poređenju sa njegovim površinskim naponom. Ova veličina je jako korisna u analiziranju strujanja tankih slojeva i formiranja kapljica i mehurića.
Naziv je dobio po Moritzu Weberu (1871–1951), a može se pisati kao:
![]()
Gde je:
- ρ gustoća fluida
- v brzina fluida
- l karakteristična dužina, na primjer, dijametar kapljice
- σ površinski napon.
Modifikovani Weberov broj:
![]()
Jednak je meri kinetičke energije pri radu i površinske energije:
![]()
Gde je:
![]()
i
![]()
ZAKLJUČAK
Površinski napon je privlačna osobina površine tečnosti. On uzrokuje
da površina dela tečnosti bude privučena do druge površine.
Primenjujući Njutnovu fiziku na sile koje nastaju zbog površinskog
napona, možemo tačno predvideti mnoga ponašanja tečnosti koja su tako
uobičajna da ih većina ljudi uzima zdravo za gotovo. Primenjujući
zakone termodinamike na te iste sile, možemo predvideti i suptilnija
ponašanja tečnosti.
Površinski napon ime dimenziju sila po jedinici dužine, ili energija
po jedinici površine. Ove dve jedinice su ekvivalentne — ali kada
se govori o energiji po jedinici površine, ljudi najčešće koriste
termin površinska energija — koji je opštiji termin u smislu da se
primijenjuje, također, i na čvrsta tela, a ne samo na tečnosti.
LITERATURA
- www.google.com
- Dr Životije Topolac, Fizika, Beograd 1978.
preuzmi
seminarski rad u wordu » » »



